Current Research
〇 認知症の発症に関わるアストロサイト機能不全分子の同定とメカニズムの解明(AMED 2022-2024)
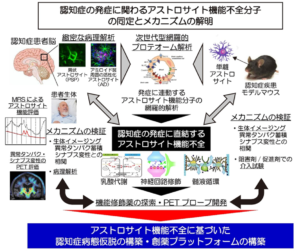
近年の疾患モデル動物を用いた研究によりアルツハイマー病(AD)をはじめとする認知症病態へのグリア細胞機能の関与が注目されている。一方、ヒト疾患脳におけるメカニズム検証は十分でなく、グリア細胞機能を標的とした認知症疾患修飾法の開発にはヒト生体およびヒト試料における病態関連グリア機能の検証が不可欠である。グリア細胞の代表格であるアストロサイトは、認知記憶に関わる乳酸分子を産生することが知られ(Suzuki et al. Cell 2011)、その乳酸分子は認知症病態の脳内において利用障害が起きている可能性を我々は報告した(Hirata et al. Ann Neurol 2023)。さらに、シナプス産生因子TSP-1の放出やGABAトランスポーターGAT-3の機能亢進を介して認知不全を引き起こすことも報告されており(Nagai et al. Cell 2019)、認知症の発症に直結する病態へのアストロサイトの関連が強く示唆される。しかしながら、認知症患者脳における体系的なアストロサイト機能不全分子の同定とメカニズム検証は進んでいない。本研究では、緻密な病理診断のなされた病態初期・進行期の認知症剖検脳において、次世代型網羅的プロテオーム解析(Uchida et al. Pharmaceutics 2021)を行い、認知症の発症に連動するアストロサイト機能分子の網羅的解析を実施する。同時に、神経変性疾患モデルマウスでアストロサイト依存性の細胞・行動異常への関与が示されたGi-GPCR経路因子(Yu et al. Neuron 2020)および乳酸シャトル経路因子の認知症剖検脳における解析を実施し、認知症の発症に関わるアストロサイト機能不全因子を明らかとする。さらに認知症患者の生体イメージング解析により、アストロサイト機能・異常タンパク蓄積・シナプス変性の相関を明らかにし、アストロサイト機能不全と認知症発症の連関をヒト生体レベルで解明することを目指す。
本研究は内田康雄教授(広島大学)、清水宏准教授(新潟脳研)、長井 淳TL(理研CBS)、小野麻衣子研究員(QST)との共同研究である。
〇 紫外線超偏極を用いたアルツハイマー病診断手法の開発(スイス-日本共同研究)
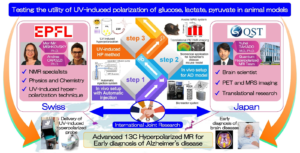
高齢者人口の増加にともなうアルツハイマー病(AD)の罹患者数の増加は、世界的に大きな社会問題になっている。現在、ADの根本的な治療法は確立されておらず、そのため、ADの病態生理の解明と早期診断、治療法の開発が急務である。これまでの研究により、アミロイドβ(Aβ)やタウタンパク質などの異常タンパク質の蓄積や神経炎症など、ADのさまざまな病態メカニズムの可能性が指摘されている一方で、発症機序の解明には新たな視点で病態を捉える必要性が近年提唱されている。次世代代謝イメージング技術の超偏極MRIは、AD病態の理解において、生化学的および生理学的に新規でユニークな視点を提供しうる。磁気共鳴(MR)法による超偏極(HP)プローブの溶解動的核偏極(dDNP)は、バイオメディカル分野において急速に発展している分野である。超偏極MR(HP-MR)は、既存のMRIを用いて生体内で豊富な代謝情報を高感度に得ることができる点が強みであるが、臨床診断に広く応用するためには、いくつかの課題が残されている。
- 既存の超偏極手法で使用されるラジカルには毒性があり、人体に投与する製剤として高い品質管理が都度求められる。
- そのため偏極から製剤化に時間を要し、信号の損失が大きいことが、より多くのHPプローブを臨床応用するための障壁となっている。
- 既存の手法では施設ごとに超偏極装置を設置する必要があり、費用や人件費を要する。
そのため、HP-MRイメージングを実施できる施設は限られており、医療現場における技術の進歩・普及が遅れている。
そこで本研究では、毒性がなくかつ施設間輸送の可能な紫外線(UV)誘導ラジカルを偏極源とする新しい超偏極手法のアプリケーションを開発することを目的とする。紫外線超偏極(UV-HP)法では、いくつかのプローブが開発されているが、生体内での検証はまだ行われておらず、AD病態での検証は未実施である。本提案が達成されると、ADの脳代謝に新たな知見をもたらすだけでなく、UVラジカルのin vivo応用の基礎となり、新規UV-HP手法の臨床現場での有用性を示す検証となるものと期待される。本研究は、スイス側PI Dr. Mor Mishkovsky及びDr. Andrea Capozziとの国際共同研究である。
〇 脳腫瘍モデルマウスにおける覚醒下超偏極MRIとPETのマルチモーダル評価基盤の構築(基盤B)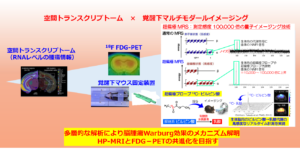
2003年に超偏極磁気共鳴イメージング(HP-MRI)の生体応用が世界で初めて報告され、同年に13Cピルビン酸の疾患モデルマウスへの応用が発表された。以後、20年の間にHP-MRIは欧米で大きな広がりを見せ、臨床研究での実用化の検討が進められている。臨床応用で先行する類似手法18F フルオロデオキシグルコース ポジトロン断層撮像法(18F FDG PET)とともに活用することで、HP-MRIのさらなる臨床応用の発展や病態研究への応用が期待されるが、HP-MRIとPETのマルチモーダル研究は未開拓である。本研究では、量研機構のイメージング環境と申請者らのHP-MRI・PET双方の経験を活かし、HP-MRIとPETの相互の発展及び脳腫瘍のWarburg効果の機序解明に資する基盤データを、脳腫瘍マウスモデルから取得することを目指す。具体的には、ヒト脳の環境に近い覚醒下マルチモダール実験と空間トランスクリプトーム解析を、2種類の異なるWarburg効果を示す脳腫瘍マウスモデルを対象に行うことで、脳腫瘍のWarburg効果のメカニズムを、細胞レベルから明らかにすることを目指す。
本研究は新潟大学脳研究所棗田学先生、量研機構山崎友照先生との共同研究である。
Current Collaborative Research
〇 脳海馬に作用し認知機能を向上する食品ペプチドの探索とそのメカニズム解明(研究代表:宇都宮大学 水重貴文先生)
〇 疼痛の中枢性感作における生体内情報の処理過程に対する動的因果モデルの検証(研究代表:北海道医療大学 照光真先生)
Previous Research
準備中
